তৃতীয় অধ্যায়
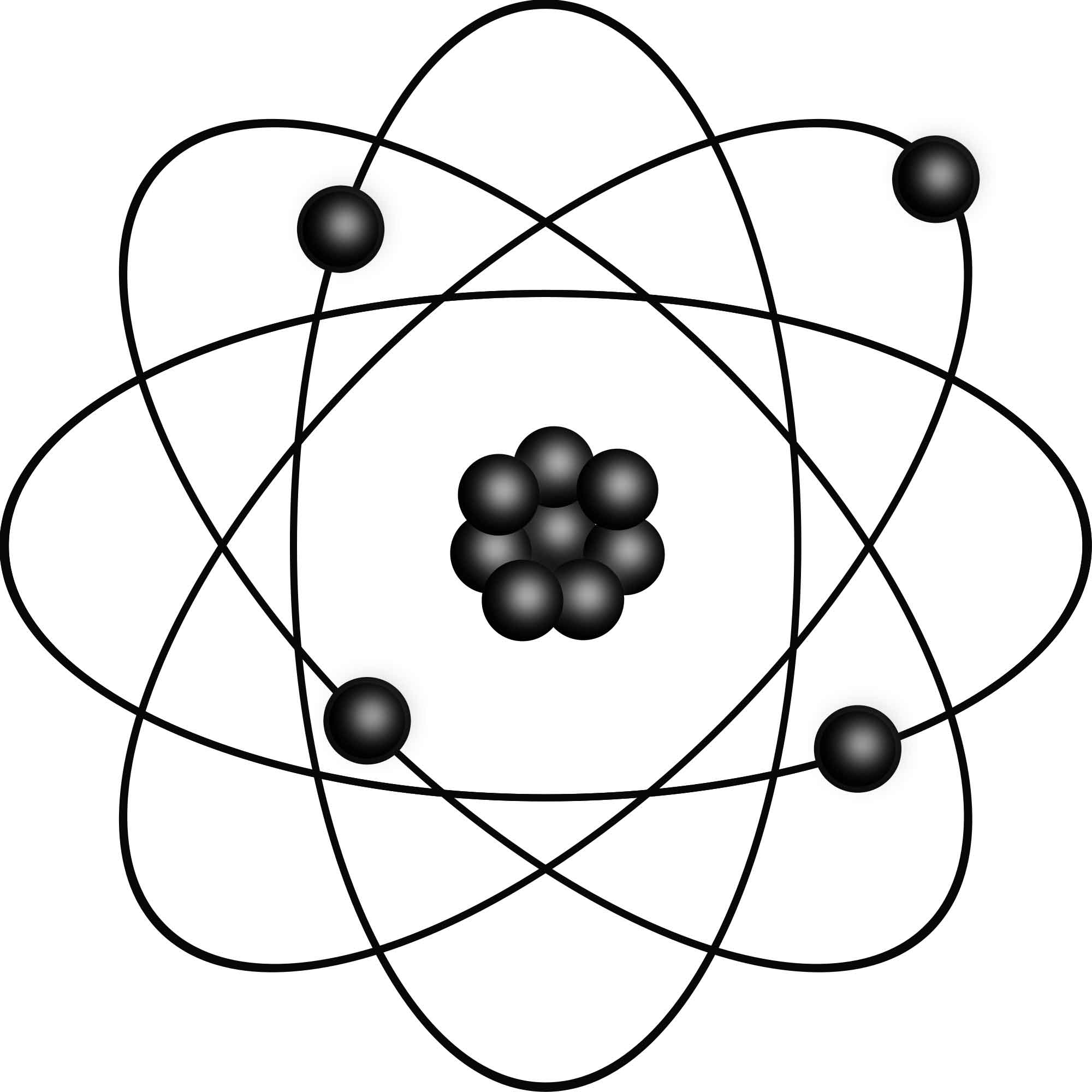
চারপাশে তোমরা যা কিছু দেখো অথবা যেগুলো দেখতে পাও না তার সবকিছুই পরমাণু (ধঃড়স) নামক অতিক্ষুদ্র কণা দ্বারা গঠিত। পরমাণু এত ক্ষুদ্রাকার এটি শুধু যে খালি চোখে দেখা যায় না তা নয়, সবচেয়ে শক্তিশালী অণুবীক্ষণ যন্ত্র দিয়েও দেখা যায় না। স্বাভাবিকভাবেই তোমাদের মনে প্রশ্ন জাগতে পারে পরমাণু কীভাবে গঠিত হয় কিংবা পরমাণুতে আসলে কী থাকে?
এর উত্তরে সহজ করে বলা যায়, পরমাণুর দুটি অংশ : (১) পরমাণুর কেন্দ্রে অবস্থিত নিউক্লিয়াস ও (২) নিউক্লিয়াসের বাইরে নিউক্লিয়াসকে কেন্দ্র করে ঘূর্ণায়মান ইলেকট্রন। ইলেকট্রন হচ্ছে ঋণাত্মক বা নেগেটিভ চার্জবিশিষ্ট এবং নিউক্লিয়াসে অবস্থিত প্রোটন ধনাত্মক বা পজিটিভ চার্জবিশিষ্ট এবং নিউট্রন হচ্ছে চার্জবিহীন।
একটি পরমাণুতে যখন সমান সংখ্যক প্রোটন ও ইলেকট্রন থাকে, তখন তার মোট চার্জ শূন্য বলে পরমাণু চার্জ নিরপেক্ষ বলে। নিউট্রন ও প্রোটনের ভর ইলেকট্রনের ভর থেকে প্রায় দুই হাজার গুণ বেশি, কাজেই পরমাণুর ভর মূলত তার নিউক্লিয়াসের ভর। ভিন্ন ভিন্ন পরমাণুর গঠন ভিন্ন হয় কারণ, তাদের প্রত্যেকটিতে ভিন্ন ভিন্ন সংখ্যক প্রোটন এবং ইলেকট্রন থাকে। মূলত এটাই বিভিন্ন মৌলগুলোর ভিন্ন ভিন্ন ধর্ম প্রদর্শনের কারণ।
পারমাণবিক সংখ্যা এবং ভর সংখ্যা
তোমরা ইতোমধ্যে পরমাণুর গঠন সম্পর্কে একটি ধারণা পেয়ে গেছ তবে পরমাণুর গঠন ভালোভাবে বুঝতে হলে পারমাণবিক সংখ্যা এবং ভর সংখ্যা সম্পর্কেও ধারণা থাকা প্রয়োজন।
পারমাণবিক সংখ্যা
কোনো পরমাণুর নিউক্লিয়াসে থাকা মোট প্রোটনের সংখ্যাই হলো ওই পরমাণুর পারমাণবিক সংখ্যা যাকে ইংরেজি অক্ষর 'ত' দ্বারা প্রকাশ করা হয়।
একই মৌলের বিভিন্ন পরমাণুর সমান সংখ্যক প্রোটন থাকে, ফলে পারমাণবিক সংখ্যাও একই হয়।
ভিন্ন ভিন্ন মৌলের পরমাণুসমূহের পারমাণবিক সংখ্যা ভিন্ন, এর কারণে একটি মৌল থেকে অন্য কোনো মৌলকে আলাদা করা যায়।
উদাহরণস্বরূপ বলা যায় হাইড্রোজেন পরমাণুতে শুধু একটি প্রোটন থাকায় তার পারমাণবিক সংখ্যা হলো ১ অক্সিজেন পরমাণুতে ৮টি প্রোটন থাকায় তার পারমাণবিক সংখ্যা ৮। যেহেতু প্রত্যেক পরমাণুতে প্রোটন সংখ্যার সমান সংখ্যক ইলেকট্রন থাকে সুতরাং আমরা বলতে পারি, হাইড্রোজেন পরমাণুতে ১টি এবং অক্সিজেন পরমাণুতে ৮ ইলেকট্রন রয়েছে।
এক পরমাণুর পারমাণবিক সংখ্যা থেকে ক এ পরমাণুতে কয়টি নিউট্রন আছে সেটি জানা সম্ভব? উত্তর হচ্ছে, না। একটি পরমাণুর পারমাণবিক সংখ্যা থেকে সেই পরমাণুতে কয়টি নিউট্রন আছে তা জানা সম্ভব নয়। কোনো পরমাণুতে কয়টি নিউট্রন আছে সেটি জানার জন্য এঁ পরমাণুর পারমাণবিক সংখ্যার পাশাপাশি ভর সংখ্যা জানতে হবে।
ভর সংখ্যা : কোনো পরমাণুর ভরসংখ্যা হলো ওই পরমাণুর মোট প্রোটন ও নিউট্রনের যোগফলের সমান যাকে ইংরেজি অক্ষর 'অ' দ্বারা প্রকাশ করা হয়। উদাহরণস্বরূপ বলা যায় কার্বন পরমাণুতে ৬টি প্রোটন ও ৬টি নিউট্রন রয়েছে, কাজেই কার্বনের ভরসংখ্যা অ হলো
১২। একই মৌলের পরমাণুসমূহের প্রোটন সংখ্যা একই থাকলেও নিউট্রন সংখ্যা আলাদা হতে পারে। অন্যদিকে, একটি ইলেকট্রনের ভর খুবই নগণ্য। কাজেই একটি পরমাণুর পারমাণবিক ভর প্রায় তার ভর সংখ্যার সমান।
যেহেতু প্রোটন এবং নিউট্রন উভয়ই পরমাণুর নিউক্লিয়াসে থাকে, তাই তাদের একত্রে নিউক্লিয়ন বলা হয়।
আগেই বলা হয়েছে যে, যদি কোনো পরমাণুর পারমাণবিক সংখ্যা ও ভর সংখ্যা জানা থাকে তাহলে এ পরমাণুর নিউট্রন সংখ্যা জানা যায়।
তেজস্ক্রিয় আইসোটোপের ক্ষতিকর প্রভাব
তোমরা ইতোমধ্যে তেজস্ক্রিয় আইসোটোপের অনেকগুলো ব্যবহার সম্পর্কে জেনে গেছ। এর সঙ্গে সঙ্গে এসব আইসোটোপ আমাদের বড় ধরনের ক্ষতি করারও ক্ষমতা রাখে। তেজস্ক্রিয় আইসোটোপ থেকে বিকিরিত আলফা, বিটা ও গামা রশ্মি আমাদের জিনগত পরিবর্তন ঘটানোর মাধ্যমে ক্যান্সার সৃষ্টি করতে পারে।
দ্বিতীয় বিশ্বযুদ্ধের সময় জাপানের হিরোশিমা ও নাগাসাকিতে যে পারমাণবিক বোমা ফেলা হয়েছিল তাতে তাৎক্ষণিকভাবে লাখ লাখ লোক মৃতু্যবরণ করে এবং পরবর্তী সময়ে তেজস্ক্রিয়তার কারণে সৃষ্ট দীর্ঘমেয়াদি জটিলতায় অনেক লোক মারা যায়। ১৯৮৬ সালে রাশিয়ায় ঘটে যাওয়া চেরনোবিল দুর্ঘটনায়ও অনেক মানুষ মারা যায় এবং স্থানীয় পরিবেশের ব্যাপক ক্ষতি হয়েছিল।
মৌলের ইলেকট্রন বিন্যাস ও তাদের ধর্ম
তোমরা ইতোমধ্যে মৌলের পারমাণবিক সংখ্যা, প্রতীক এবং ইলেকট্রন বিন্যাস সম্পর্কে ধারণা পেয়ে গেছ। মৌলিক পদার্থের ধর্ম মূলত তাদের পরমাণুর ইলেকট্রন বিন্যাসের ওপর নির্ভর করে। ইলেকট্রন বিন্যাসের ভিন্নতার কারণেই পরমাণুগুলো সক্রিয়, নিষ্ক্রিয়, ধাতব, অধাতব, পরিবাহী, অপরিবাহী এরকম ভিন্ন ভিন্ন ধর্মের হয়ে থাকে।
উদাহরণ দেওয়ার জন্য বলা যায়, যদি সর্বশেষ কক্ষপথে ধারণ ক্ষমতার সর্বোচ্চ পরিমাণ ইলেকট্রন থাকে তাহলে কক্ষপথটিকে সম্পূর্ণরূপে পূর্ণ বলা হয় এবং এই ধরনের পরমাণুগুলো নিষ্ক্রিয় হয়। যেমন- হিলিয়াম পরমাণুতে ২টি ইলেকট্রন রয়েছে, এই দুটি ইলেকট্রন প্রথম কক্ষপথে অবস্থান করে।
প্রথম কক্ষপথে যেহেতু সর্বোচ্চ ২টি ইলেকট্রন থাকতে পারে তাই হিলিয়াম পরমাণু নিষ্ক্রিয়। একইভাবে নিয়ন (ঘব-১০) গ্যাসের বেলায় সর্বশেষ কক্ষপথে ৮টি ইলেকট্রন তার দ্বিতীয় কক্ষপথ সম্পূর্ণরূপে পূর্ণ করেছে বলে এই গ্যাসটিও নিষ্ক্রিয়।
আয়ন সৃষ্টি (ঋড়ৎসধঃরড়হ ড়ভ রড়হং)
কখনো কখনো একটি পরমাণু তার সর্বশেষ কক্ষপথের এক বা একাধিক ইলেকট্রন গ্রহণ বা ত্যাগ করে তার নিকটতম নিষ্ক্রিয় গ্যাসের মতো স্থিতিশীলতা অর্জন করতে পারে। যেসব পরমাণু ঋণাত্মক চার্জবিশিষ্ট ইলেকট্রন ত্যাগ করে তারা আর চার্জ নিরপেক্ষ না থেকে ধনাত্মক বা পজিটিভ চার্জে চার্জিত হয়। আবার যারা ইলেকট্রন গ্রহণ করে তারা ঋণাত্মক বা পজিটিভ চার্জে চার্জিত হয়। এসব চার্জযুক্ত পরমাণুকে আয়ন বলা হয়।
যখন কোনো পরমাণুর সর্ববহিঃস্থ শক্তিস্তর থেকে এক বা একাধিক ইলেকট্রন ত্যাগ করে নিকটতম নিষ্ক্রিয় গ্যাসের মতো স্থিতিশীল ইলেকট্রন বিন্যাস লাভ করে, তখন সেটি ধনাত্মক বা পজিটিভ চার্জযুক্ত আয়নে পরিণত হয়। এই ধরনের আয়নকে ক্যাটায়ন বলে। উদাহরণ হিসেবে সোডিয়াম পরমাণুর কথা বিবেচনা করা যাক।
সোডিয়ামের প্রথম শক্তিস্তরে ২টি ইলেকট্রন, দ্বিতীয় শক্তিস্তরে ৮টি ও সর্বশেষ তৃতীয় শক্তিস্তরে ১টি ইলেকট্রন থাকে। সোডিয়াম পরমাণু যদি তার তৃতীয় শক্তিস্তরের একটি ইলেকট্রন ত্যাগ করে তাহলে ২য় শক্তিস্তরটি সর্ববহিঃস্থ শক্তিস্তরে পরিণত হয় যেটি ৮টি ইলেকট্রন দ্বারা পরিপূর্ণ।
এভাবে সোডিয়াম তার নিকটবর্তী নিষ্ক্রিয় গ্যাস নিয়নের মতো স্থিতিশীল ইলেকট্রন বিন্যাস লাভ করে। যখন অন্য কোনো পরমাণু যেগুলোর ইলেকট্রন গ্রহণ করার ক্ষমতা আছে, সোডিয়াম পরমাণুর সংস্পর্শে আসে, তখন সোডিয়াম খুব সহজেই তার তৃতীয় শক্তিস্তর থেকে একটি ইলেকট্রন ত্যাগ করে।
আবার যখন কোনো পরমাণুর সর্ববহিঃস্থ শক্তিস্তর এক বা একাধিক ইলেকট্রন গ্রহণ করে নিকটতম নিষ্ক্রিয় গ্যাসের মতো স্থিতিশীল ইলেকট্রন বিন্যাস লাভ করে, তখন সেটি ঋণাত্মক বা নেগেটিভ চার্জযুক্ত আয়নে পরিণত হয়, এই ধরনের আয়নকে অ্যানায়ন বলে। পারমাণবিক সংখ্যা ৯ বিশিষ্ট ফ্লোরিন পরমাণুর ইলেকট্রন বিন্যাস হলো ২, ৭।
ফ্লোরিন স্থিতিশীল নয়, স্থিতিশীলতার জন্য এটির বহিঃস্থ স্তরে ৮টি ইলেকট্রন দরকার দ্বিতীয় শক্তিস্তরে ৮টি ইলেকট্রনের জন্যে এটি তার বহিঃস্থ স্তরের ৭টি ইলেকট্রন ত্যাগ করতে পারে অথবা কোথাও থেকে একটি ইলেকট্রন গ্রহণ করতে পারে।
শক্তির বিবেচনায়, দ্বিতীয় শক্তিস্তরে একটি ইলেকট্রন গ্রহণ করা ৭টি ইলেকট্রন ত্যাগ করার চেয়ে অনেক বেশি সহজ। সোডিয়াম পরমাণুর সংস্পর্শে এটি খুব সহজেই একটি ইলেকট্রন গ্রহণ করতে পারে। ইলেকট্রন গ্রহণ করার পর ফ্লোরিন পরমাণুটি ঋণাত্মক বা নেগেটিভ চার্জযুক্ত আয়নে পরিণত হয়, যাকে অ্যানায়ন বলে।